成年雄性动物通过持续的精子发生维持功能性配子的产生,睾丸微环境分泌的雄激素是调控精子发生的关键信号分子。然而,雄激素调控精子发生的分子机制仍不清楚。揭示雄激素调控精子发生的分子机制对改良和保护种公畜繁殖力、防治男性生殖障碍等都具有重要的意义。
睾丸微环境对精原干细胞的命运调控研究是全讯800cc大白菜官网干细胞研究与转化中心的一个核心方向。从2014年开始,实验室开始搭建研究平台,构建体内体外研究模型,结合高通量测序技术、生物信息学方法等前沿技术,致力于探究雄激素调控精子发生的分子机理。经过8年的努力,较为系统的研究了睾丸微环境中的雄激素信号影响精原干细胞命运的分子通路,不仅为大动物生殖干细胞的研究提供了参考,也为下一阶段的应用转化研究提供了理论基础。
硕士生李金梅的工作首先发现雄激素受体(androgen receptors,AR)在归巢(homing)前的性原细胞(gonocyte)中表达,以及在体外培养模型中发现,添加二氢睾酮(DHT)需通过支持细胞(Sertoli cells)为媒介,才能影响精原干细胞(Spermatogonial stem cells,SSCs)的分化,因此确定雄激素信号必须通过Sertoli细胞间接调控精原干细胞分化。博士生汪晶晶开展的进一步分子机制研究中,通过收集Sertoli cells进行ChIP-seq试验,筛选出了一条支持细胞中AR的基因调控通路。此外还发现,ITGB1和SSCs中E-cadherin存在相互作用,间接调控SSCs的关键转录抑制因子PLZF的表达,维持SSCs的未分化状态(图1)(Cell Communication and Signaling. 2019)。
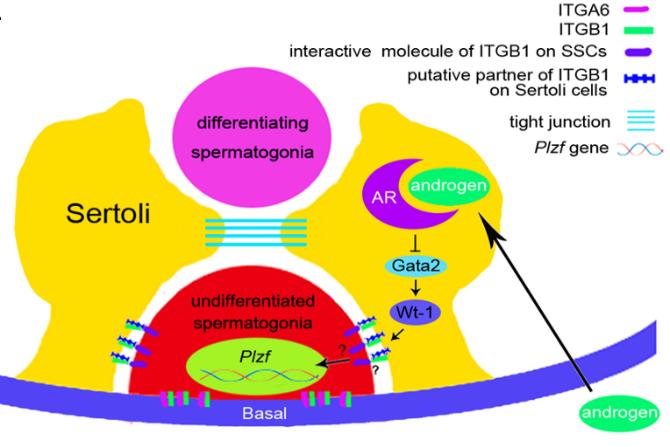
图1 支持细胞中雄激素信号调控精原干细胞的命运
在另一项相关工作中,硕士生夏钦发现了雄激素通过AR的下游靶基因Cx43来调控睾丸微环境的缝隙连接(Gap Junction),影响SSCs与Sertoli cells之间的相互作用(图2)(Stem Cells and Development. 2020)。
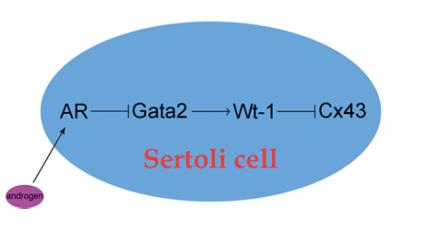
图2 支持细胞中雄激素信号的调控通路
此外,博士生宋伟翔通过筛查转录抑制因子PLZF的下游靶基因,发现PLZF通过结合抑制Ckit、Stra8、Sohlh2和Dmrt1的表达来维持SPCs的未分化状态(图3),解答了雄激素信号如何影响PLZF来启动精子发生作用 (Journal of Cellular Physiology.2020)。
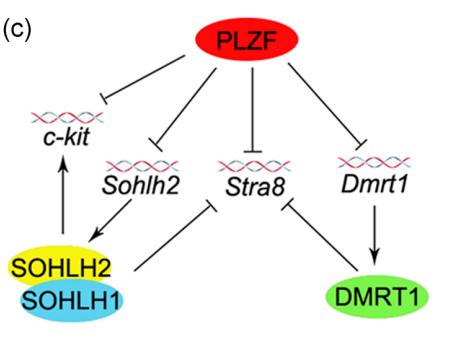
图3 PLZF的下游靶点基因
上述工作找到了雄激素信号介导的Sertoli细胞-精原干细胞之间的相互作用,也明确了PLZF抑制分化的靶点。然而,Sertoli细胞如何与精原干细胞相互作用来调控精原干细胞的分化这一关键问题,仍未能得到解答。
团队的前期工作虽然找到了ITGB1与E-cadherin的相互作用,但E-cadherin的功能和调控机理仍不清晰。尤其是不同团队对E-cadherin的互作蛋白beta-catenin的功能存在争议。宋伟翔、张丹琛等同学通过E-cadherin条件性敲除小鼠模型和体外长期培养的精原祖细胞(spermatogonial progenitor cells,SPCs)模型,进一步揭示了E-cadherin在维持SPCs细胞群中的调控机制,即通过β-catenin及β-catenin的互作蛋白HDAC4和STAT3来抑制SPCs的分化(图4)(Cell & Bioscience. 2022)。
这一工作的完成,标志着雄激素间接调控精原干细胞分化命运的调控通路框架已搭建完成,后续的工作重心则是在大框架的基础上的继续完善细节,以及理论向应用的转化。
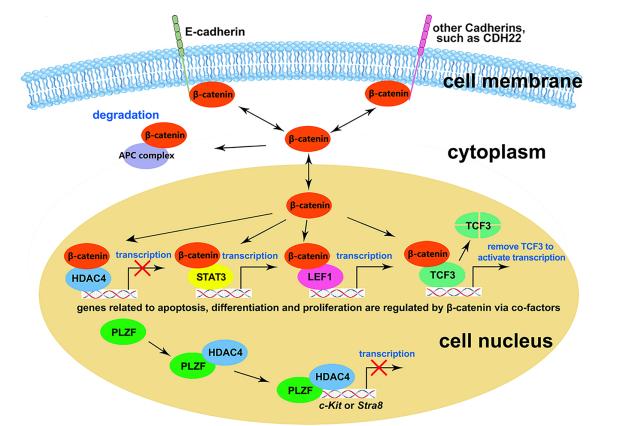
图4 E-cadherin通过中间分子β-catenin调节SPCs细胞的命运
上述工作共分为三个部分:雄激素信号在Sertoli细胞向细胞膜蛋白的传递;Sertoli细胞与精原干细胞之间的膜蛋白的相互作用与信号传递;精原干细胞表面膜信号向细胞核的传递。经过团队成员的不懈努力,较为系统的探究了从微环境分泌的雄激素信号到精原干细胞分化的整个信号通路的调控机制,重点关注了睾丸微环境内的细胞之间的相互作用模式及精原干细胞调控信号的分子应答反应,为揭示雄性动物精子发生的调控机理有一定的参考价值,为雄性动物繁殖力的保护、生殖疾病的防治都提供了新的理论基础。
理论上的成果终将转向应用。下一阶段,全讯800cc大白菜官网干细胞研究与转化中心将在这些理论工作的基础上开拓应用空间,在家畜繁殖、生殖医学方向开展技术开发合作,解决生产和应用上的关键问题。
致谢:上述工作得到了中央高校基本业务费(KYTZ201602)、江苏特聘教授人才项目和江苏省种业振兴项目(JBGS[2021]024)等基金的支持。